محتويات
الجزيئات والمادة
تتشابه خصائص جزيئات المادة الواحدة فيما بينها، وتختلف عن خصائص المواد الأخرى، ويتألف الجزيء من وحدات هيكلية صغيرة تدعى الذرات، ويُمكن تعريفه بأنه مجموعة متلاصقة من ذرتين أو أكثر يصعب رؤيتها بالعين المجردة لصغر حجمها، وتجدر الإشارة إلى أن جزيئات المواد غير النقية تختلف ذراتها من حيث العدد والنوع ونوع الرابطة بينها وتوجد ثلاثة أشكال لجزيئات المادة وهي العنصر والمركب والخليط[١].
مفهوم الوزن الجزيئي
يوصف الزن الجزيئي أساسًا بالكتلة الجزيئية ويُمكن أن يُعبر عنها بالوزن الجزيئي، وهي مجموعة من الكتل الذرية المكونة لجزيء المادة، وعند اعتمادنا وحدة القياس الغرام للوزن الجزيئي يُطلق عليه الوزن الجزيئي الغرامي، وقد تختلف الكتلة الذرية للذرات نفسها حسب عدد النيوترونات والبروتونات الموجودة في النواة، ويُطلَق على الكتلات الذرية المختلفة النظائر التي تختلف حسب العوامل الجيولوجية المؤثرة عليها، لذلك لا يُمكن للكتلة الذرية أن تكون دقيقةً، لكن يُمكن اختيار أكثر النظائر للذرة وجودًا في الطبيعة لتكون الكتلة الذرية التقريبية شبه دقيقة، فمثلًا ذرة الكربون توجد لها ثلاثة نظائر في الطبيعية جميعها تحتوي على ستة بروتونات، وتختلف بعدد النيوترونات التي تحتوي عليها فبعضها يحتوي على ستة، وبعضها على سبعة أو على ثمانية، وبذلك تكون النظائر للكتلة الذرية هي 12-13-14، وأكثر النظائر وجودًا هي النظير 12 لذا فالكتلة الذرية التقريبية الصحيحة هي 12.011، ومن هنا يظهر أن الوزن الجزيئي قد لا يكون دقيقًا لوجود عدة نظائر لكتلة الذرات المكونة لجزيء المادة، لكن يُمكننا اعتماد أكثر النظائر وجودًا في الطبيعة ليكون الوزن الجزيئي أكثر دقةً وأقرب للأصح[٢][٣].
حساب الوزن الجزيئي
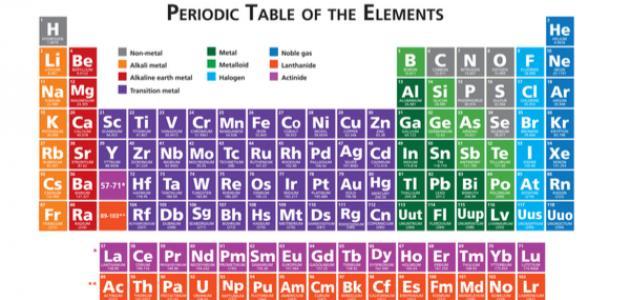
يُمكن حساب الوزن الجزيئي من خلال جمع أوزان الذرات المكونة لجزيء العنصر، وذلك بعد الرجوع إلى الجدول الدوري لمعرفة الكتلة الذرية لكل عنصر وفقًا للمعادلة الحسابية: الوزن الجزيئي = (وزن الذرة س × عددها) + (وزن الذرة ص × عددها)، فمثلًا لو أردنا حساب الوزن الجزيئي للكلور CL2 المكون من ذرتين متماثلتين ننظر إلى الجدول الدوري فنجد أن الكتلة الذرية للعنصر 35.453، ثم نعوض وفق المعادلة الحسابية للوزن الجزيئي: amu = 35.453 × 2 = 70.906 وحدة كتلة ذرية. والكتلة الجزيئية الغرامية هي 70.906 غرامًا.
لحساب كتلة الماء H2O المكون من ذرتي هيدروجين H وذرة أوكسجين، نعود إلى الجدول الدوري لنجد الوزن الذري للهيدروجين H 1.008 أما الوزن الذري للأوكسجين فيكون 15.999. نُعوِّض وفق المعادلة الحسابية للوزن الجزيئي 2 × (1.0079 amu) + 1 × (15.9994 amu) = 18.01528 amu وحدة كتلة ذرية. والكتلة الجزيئية الغرامية 18.015 غرامًا[٤].
الكتلة المولية
تُعد وحدة المول الوحدة الأساسية المستخدمة للقياس في الكيمياء كما أن قيمة الواحد مول تساوي عدد ذرات الكربون الموجودة في وزن 12 غرامًا من كتلة عينة كربونية ذات النظير 12، ومن الجدير بالذكر أن كمية الواحد مول من أي مادة تساوي 6.0221367E^23 ذرة، وهذا الرقم يُطلَق عليه عدد أفوغادرو، فعلى سبيل المثال قيمة الواحد مول من الكربون تساوي 6.0221367E^23 ذرة كربون، وقيمة الواحد مول من الفلافل تساوي 6.0221367E^23 ذرة فلافل وعليه يمكن تعميم أن قيمة الواحد مول من أي شي تساوي 6.0221367E^23 ذرة الشيء نفسه، وتجدر الإشارة إلى أن الكتلة المولية للصيغة الكيميائية تساوي مجموع الكتل الذرية لهذة الصيغة، ويستخدم العلماء قيمة الكتلة المولية لحساب وزن أي مادة كيميائية سواء أكانت عنصرًا أم مركبًا بحساب عدد مولات أي مادة والذي يساوي كتلة العنصر بوحدة الغرام مقسومة على الكتلة المولية لهذا العنصر، ولإيجاد قيمة الكتلة المولية للمركب H2SO4 نتبع الخطوات التالية[٥]:
- كتابة قائمة توضح عدد ذرات كل عنصر للمركب وهي: {H:2،S:1،O:4}.
- تحديد الكتلة الذرية لهذه العناصر بعد الرجوع للجدول الدوري وهي: {H:1.00794،S:32.066،O:15.9994}.
- ضرب قيم الكتل الذرية بعدد الذرات الموازية لكل عنصر.
| H | 2×1.00794 | 2.015 |
| S | 1×32.066 | 32.066 |
| O | 4×15.9994 | 63.998 |
الكتلة المولية للمركب تساوي 98.079 وهي ناتج المجموع الجبري لقيم الخطوة السابقة (2.015+32.066+63.998) وتجدر الإشارة إلى أن قيمة الكتلة المولية للمركب قُرِّبت لأقرب ثلاث منازل بعد الفاصلة العشرية اعتمادًا على أقل قيمة كتلة ذرية والتي توازي عنصر الكبريت في هذا المثال، وتُراعى الدقة في إجراء العمليات الرياضية لحاصل جمع الكتل المولية إذ إنها تحدد العلاقات ونسب الكميات بين حدود المعادلات الكيميائية.
المصطلحات الكيميائية الأساسية
فيما يأتي أهم المصطلحات لفهم مكونات الذرة والجزيئات وبعض خصائصها الفيزيائية[٦]:
- الذرة: هي الوحدة الأساسية متناهية الصغر في بنية المادة، والجزء الأدق منها الذي لا يُمكن تجزئته لأجزاء أخرى أصغر، وتُعد ذرة الهيدروجين H أخف الذرات وأصغرها على الإطلاق .
- الجزيء: هو الجزء الأساسي في بنية المادة مكون من اتحاد ذرتين أو أكثر قد تكونان متشابهتين، وقد تكونان مختلفتين، وبفضل ذراته تتغير المادة لمادتين أو ما يزيد عن ذلك حسب الذرات المكونة له، مثل جزيء الكلور CL2 المكون من ذرتين متماثلتين، أو جزيء الماء H2O المكون من ذرتي هيدروجين وذرة أوكسجين وبفصل ذراته يظهر لنا هذان العنصران.
- الكتلة: هي مقدار فيزيائي ثابت يُعبر عن مقياس ما تحتويه المادة من مكونات، كما أنها تُماثل لترًا واحدًا من الماء، ووحدة قياسها الكيلوغرام.
- الكتلة الذرية أو الوزن الذري: وهي مجموع ما تحتويه نواة لذرة مادة مكونة من البروتونات والنيوترونات، وهي جسيمات دقيقة أصغر من الذرة بكثير تكون موجودةً في نواتها.
- العدد الذري: يعني النسبة من متوسط كتلة ذرة عنصر كيميائي معين وفقًا للعديد من المعايير، وتكون وحدة قياس الكتلة الذرية واحدًا على اثني عشر من كتلة ذرة الكربون 12، وتُعد هذه الكتلة من أكثر نظائر كتلة ذرة الكربون الموجودة في الطبيعة، أما النظائر الأخرى له فهي 13 و14.
- النيوترونات: جسيمات تكون موجودة في نواة الذرة تُشابه البروتون من حيث الكتلة ولا تحمل شحنةً كهربائيةً.
المراجع
- ↑ "What are the kinds of molecules", online-sciences, Retrieved 29-11-2019. Edited.
- ↑ "atomic-mass-and-mass-number", thoughtco, Retrieved 26-11-2019. Edited.
- ↑ "atomic-weight-and-atomic-mass-difference", thoughtco, Retrieved 26-11-2019. Edited.
- ↑ "Formula_and_Molecular_Weights", libretexts, Retrieved 26-11-2019. Edited.
- ↑ "Molar Mass Calculations", environmentalchemistry, Retrieved 26-11-2019. Edited.
- ↑ "UNChem glossary", shodor, Retrieved 26-11-2019. Edited.